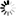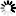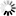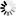核心提示:知识点总结1、常见气体制备的反应原理:(2)H2的实验室制法:Zn+H2SO4(稀)=ZnSO4+H2↑(4)SO2的实验室制法:Na2SO3(s)+ H2SO4(浓)=Na2SO4+H2O+SO2↑...
知识点总结
1、常见气体制备的反应原理:

(2)H2的实验室制法:Zn+H2SO4(稀)=ZnSO4+H2 ↑
![]()
(4)SO2的实验室制法:Na2SO3(s)+ H2SO4 (浓)=Na2SO4+H2O+SO2↑
(5)NH3的实验室制法: Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O
2、常用的气体干燥剂按酸碱性可分为三类:
(1)酸性干燥剂,如浓硫酸、五氧化二磷等。酸性干燥剂能够干燥显酸性或中性的气体,如CO2、SO2、NO2、HCI、H2、Cl2 、O2、CH4等气体。
(2)碱性干燥剂,如生石灰、碱石灰、固体NaOH。碱性干燥剂可以用来干燥显碱性或中性的气体,如NH3、H2、O2、CH4等气体。
(3)中性干燥剂,如无水氯化钙等,可以干燥中性、酸性、碱性气体,如O2、H2、CH4等。在选用干燥剂时,显碱性的气体不能选用酸性干燥剂,显酸性的气体不能选用碱性干燥剂。有还原性的气体不能选用有氧化性的干燥剂。能与气体反应的物质不能选作干燥剂,如不能用CaCI2来干燥NH3(因生成 CaCl2·8NH3),不能用浓 H2SO4干燥 NH3、H2S、HBr、HI等。
3、常见的气体净化装置:

A.用固体物质除去气体杂质(包括水蒸气);如图(1)、(2)、(3)。
B.用液体物质除去气体杂质(包括水蒸气);如图(4)。
4、气体的收集:
(1)排水法用于收集难溶于水的气体:H2、CH4、NO、O2、N2、C2H2。

(2)向上排空气法用于收集密度大于空气的气体:Cl2、HCl、H2S、CO2、SO2、NO2。
(3)向下排空气法用于收集密度小于空气的气体:H2、NH3、CH4。

5、尾气处理方法: